「新闻」君赛生物首款TIL细胞新药获得NMPA临床试验默示许可
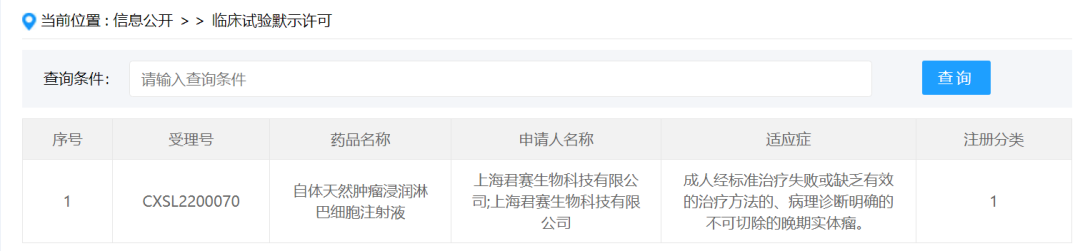
2022年4月24日,上海君赛生物科技有限公司(以下简称君赛生物)自主开发的首款TIL细胞药物“自体天然肿瘤浸润淋巴细胞注射液(GC101 TIL)”(受理号:CXSL2200070)正式获得国家药品监督管理局(NMPA)的临床试验默示许可。该品种是全球首个无需清淋、无需IL-2注射的天然TIL细胞药物,其有效性与安全性经过临床验证,可大幅提高TIL细胞疗法的可及性。
关于GC101 TIL
TIL细胞疗法从新鲜肿瘤组织中分离与富集肿瘤杀伤性细胞,经体外功能修复与规模扩增,通过静脉回输到患者体内发挥抗肿瘤效果,已在多种类型晚期实体瘤上展现高比例、长持久性的客观缓解疗效,是最具潜力的实体瘤疗法之一。作为一种高度个性化的细胞免疫疗法,生物工艺CMC直接决定所分离制备细胞的质量与临床疗效,且需最大程度兼顾不同肿瘤组织样本的异质性,对工艺稳定性与质量管理体系构成重大挑战。放眼全球,仅美国Iovance公司TIL产品管线(Lifileucel)完成晚期黑色素瘤的II期临床试验,即将提交FDA的新药上市申请。同时,以Iovance公司为代表的传统TIL细胞疗法,细胞体外规模扩增依赖异源滋养细胞;TIL细胞回输前必需非清髓性清淋预处理,回输后必需大剂量IL-2的反复注射,工艺较复杂、临床局限性较大。
君赛生物已建成高标准的GMP级生产车间与质控实验室,自主开发建立标准化的TIL细胞制备工艺与配套质量管理体系。同时,面向临床方案的简化,建立原创的TIL细胞培养专利技术体系,在省略异源滋养细胞的前提下,TIL细胞数量达到百亿级,且以记忆性细胞为主体,不同瘤种TIL培养成功率>90%。临床方案方面,在TIL细胞回输前,无需清淋性预处理;细胞回输后无需IL-2的注射,即可实现TIL细胞在体内有效增殖。患者可在普通病房里接受治疗,大大提高TIL细胞疗法的安全性与可及性,显著降低相关临床费用。
GC101是君赛生物的首款TIL细胞新药品种,在前期研究者发起的临床研究(IIT)中,展现良好的安全性与有效性。2例受试者达到完全缓解(CR)疗效,3例受试者达到部分缓解(PR)疗效,CR持续时间已分别超过8个月与6个月,代表性临床结果发表在国际知名癌症免疫治疗杂志Journal for ImmunoTherapy of Cancer。
关于君赛生物
上海君赛生物科技有限公司成立于2019年,专业致力于基因-细胞创新疗法的开发,已通过国家级高新技术企业资质认定。公司自主建立全球领先的创新型天然TIL细胞与基于非病毒载体基因修饰TIL细胞产品管线,核心技术已布局国际PCT与中国发明专利,获得多项上海市科委、发改委专项课题资助。公司拥有一支国际化的、专业的细胞新药开发与临床团队,核心成员均具有细胞新药的成功开发经验,正在全国知名三甲医院合作开展9项NCT注册的TIL细胞临床研究。公司拥有2000平方米的GMP级生产车间与质控实验室,可满足不同管线的并行开发。已完成三轮融资,融资额近2.5亿元,现有投资方包括元禾原点、复容、凯泰、幂方、怀格、朗姿韩亚、黄埔医药、华医、元生创投等知名生物医药基金。
