KRAS突变肺癌患者肿瘤快速缩小
肺癌是全球第一大确诊癌症,也是导致癌症相关死亡的首要原因,我国肺癌发病和死亡人数均约占全球40%。肺癌患者中约80-85%为非小细胞肺癌(NSCLC),在我国约10%的NSCLC患者携带KRAS基因突变。目前,KRAS突变治疗方案有限,存在巨大未满足的临床需求。
近日,一位KRAS G12D突变的NSCLC患者在回输君赛生物GC101 TIL后的首次肿瘤评估,肿瘤整体缩小45%,达到部分缓解(PR)。
GC101依托君赛生物自主开发的DeepTIL®细胞扩增平台研发而成,无需高浓度IL-2和滋养细胞即可培养出足够数量的高活性TIL细胞,且对IL-2无依赖性。临床应用中,GC101无需清淋和任何剂量的IL-2注射,有效解决了常规TIL依赖大剂量化疗清淋预处理,大剂量IL-2注射的临床痛点。
屡次展现良好安全性和疗效的背后(此前报道:进击的TIL,GC101使肺癌患者病灶持续缩小),正在一步步确证君赛生物创新TIL疗法技术平台的优势和GC101颇具潜力的前景。
目前,君赛生物国内首个专门针对肺癌的TIL细胞药物注册临床试验(MIZAR-005)已在上海市胸科医院、安徽省胸科医院正式启动,后续将陆续在湖南省肿瘤医院等更多医疗机构启动。
该KRAS G12D突变患者于2022年4月开始偶感左胸疼痛,经检查确诊为肺腺癌,ⅣB期。在经历了免疫与化疗的联合治疗后,半年后疾病进展。之后患者又经历了免疫、抗血管生成抑制剂与化疗的联合治疗,但因无法耐受药物的不良反应,最终停药,病情也迅速恶化。
在非靶向治疗已无法控制住肿瘤进展,而KRAS G12D目前尚无任何已上市靶向药物的情况下,患者及家属已经无所适从。
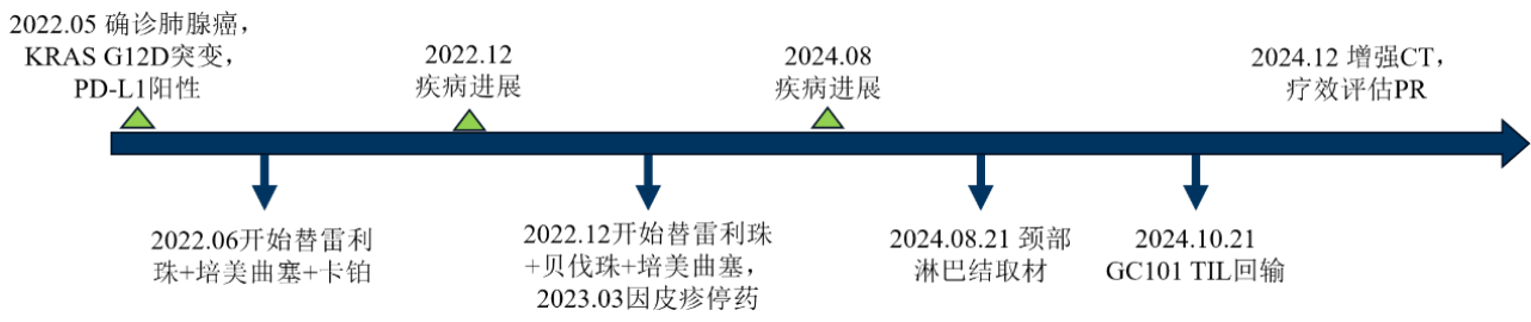
希望重燃于一个新的选择--TIL细胞疗法。在了解GC101无需清淋级预处理、无需IL-2注射、普通病房即可治疗的临床方案,及前期在多种类型晚期实体肿瘤中的良好安全性和疗效后,该患者毅然参与了君赛生物GC101临床试验。
接受GC101 TIL细胞单次回输后,该患者除了短暂的一过性血象降低,无其他不良反应。在TIL回输后42天的疗效评估中,肿瘤缩小已达到45%,同时肿瘤标志物(癌胚抗原)明显下降,并已恢复至正常范围。患者明显感觉癌痛减轻,而且颈部淋巴结自己已经摸不到了。
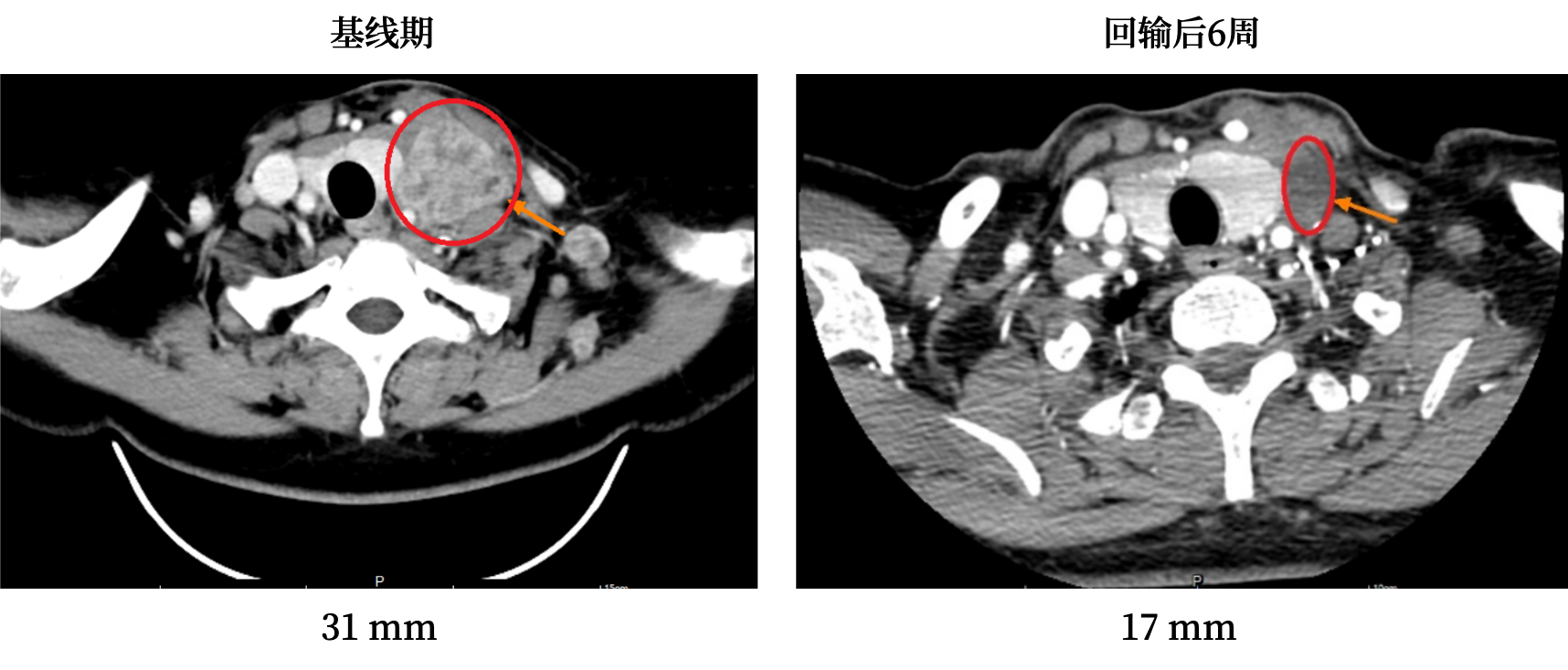
患者接受TIL治疗前和治疗后6周增强CT扫描结果(左侧颈部淋巴结)
关于GC101
GC101依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增平台开发而成,是君赛生物研发进度最快的TIL疗法管线,也是全球首款无需清淋、无需IL-2注射的天然TIL疗法,在发挥TIL疗效的同时,大幅提高TIL疗法的安全性与可及性,降低对患者身体条件的重重限制。
已有临床数据显示,GC101针对多种类型晚期实体肿瘤的客观缓解率(ORR)超35%,已有4例患者肿瘤被完全清除,获得完全缓解(CR)疗效,其中无瘤生存最久时间已超3年。
关于MIZAR-005临床试验
MIZAR-005是一项评价自体天然肿瘤浸润淋巴细胞注射液(GC101 TIL)治疗晚期非小细胞肺癌患者安全性和有效性的开放标签、单臂、Ⅰb期临床试验。
本临床试验项目已在上海市胸科医院、安徽省胸科医院正式启动,后续将陆续在湖南省肿瘤医院等医疗机构启动。现已开始进行受试者招募及筛选,招募主要标准如下。
主要入组标准:
1、18-70岁,男女不限;
2、确诊的驱动基因阳性的不可切除的晚期非小细胞肺癌患者;
3、经过靶向(如有上市药物)及含铂双药化疗治疗后失败;
4、至少2个病灶,身体可支持微创手术取材;
5、ECOG评分0-1分;
6、有足够的血液学和终末器官功能。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
3、肺纤维化、间质性肺病(包括病史)、急性肺病;
4、脑转移且伴有临床症状或病灶大小不稳定。
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
张老师:18019732895(同微信)
程老师:18001759113(同微信)
