GC101关键II期临床首个分中心顺利启动
2025年1月14日,君赛生物全球首款无需清淋、无需IL-2注射的天然TIL疗法GC101的关键II期临床试验(MIZAR-003)首个分中心启动会在福建省肿瘤医院顺利召开。这是继上月底组长单位北京大学肿瘤医院启动试验并完成首批患者入组后,MIZAR-003项目的又一快速突破。
福建省肿瘤医院党委委员、副院长陈誉教授,肿瘤内科十九病区兼I期病房临时负责人林晶主任及相关临床研究团队,君赛生物副总裁林树伟及相关支持人员参加此次启动会。
黑色素瘤是一种侵袭性皮肤癌,其发病率不断上升。2022年中国黑色素瘤新发人数占全球2.7%,但死亡数占全球的9.2%,死亡率更高,治疗需求迫切。
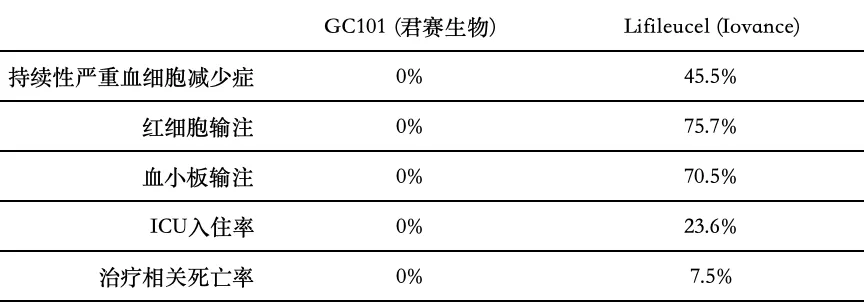
GC101依托君赛生物自主开发的DeepTIL®细胞扩增平台研发而成,无需滋养细胞、无需高浓度IL-2即可培养出足够数量的高活性TIL细胞,且对IL-2无依赖性。既往数据表明,针对国内更难治疗的肢端和黏膜型黑色素瘤患者,GC101在保证良好安全性的条件下,ORR与全球唯一上市黑色素瘤TIL疗法Lifileucel相似,且mPFS延长了一个多月。
表1 GC101与Lifileucel安全性相关数据
在临床应用中,患者在普通病房即可接受GC101 TIL治疗,且无需清淋和任何剂量的IL-2注射,有效避免传统TIL疗法因需要高强度的清淋化疗和大剂量IL-2重复注射可能对患者带来的众多不良反应。
福建省肿瘤医院党委委员、副院长陈誉教授表示:“国内晚期黑色素瘤治疗难度大、预后不良,临床上需要创新的治疗方法。君赛生物GC101 TIL有别于传统TIL疗法的临床管理便利性,卓越的前期安全性和疗效数据让我们对GC101关键II期临床试验充满期待,希望更多晚期黑色素瘤患者能从中获益!”
关于GC101
GC101依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增平台开发而成,是君赛生物研发进度最快的TIL疗法管线,也是全球首款无需清淋、无需IL-2注射的天然TIL疗法。
已有临床数据显示,GC101针对多种类型晚期实体肿瘤的客观缓解率(ORR)超35%,已有4例患者肿瘤被完全清除,获得完全缓解(CR)疗效,其中无瘤生存最久时间已超3年。
关于MIZAR-003临床试验
MIZAR-003项目是一项开放标签、随机、对照、多中心关键II期临床试验,旨在评估GC101 TIL细胞疗法在晚期黑色素瘤患者中的有效性与安全性。目前,MIZAR-003临床试验分中心正在迅速启动。
主要入组标准:
1、18-75岁,男女不限;
2、不可切除的晚期、复发或转移性黑色素瘤患者(葡萄膜黑色素瘤除外);
3、经PD-1抗体治疗失败或不耐受;
4、至少2个病灶,身体可支持微创手术取材。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
杨老师:18019732895(同微信)
张老师:18001759113(同微信)