「GC101关键II期临床」武汉协和医院分中心顺利启动
2025年1月24日,春节将至,君赛生物全球首款无需清淋、无需IL-2注射的天然TIL疗法GC101的关键II期临床试验(MIZAR-003)分中心启动会,如期在华中科技大学同济医学院附属协和医院召开。
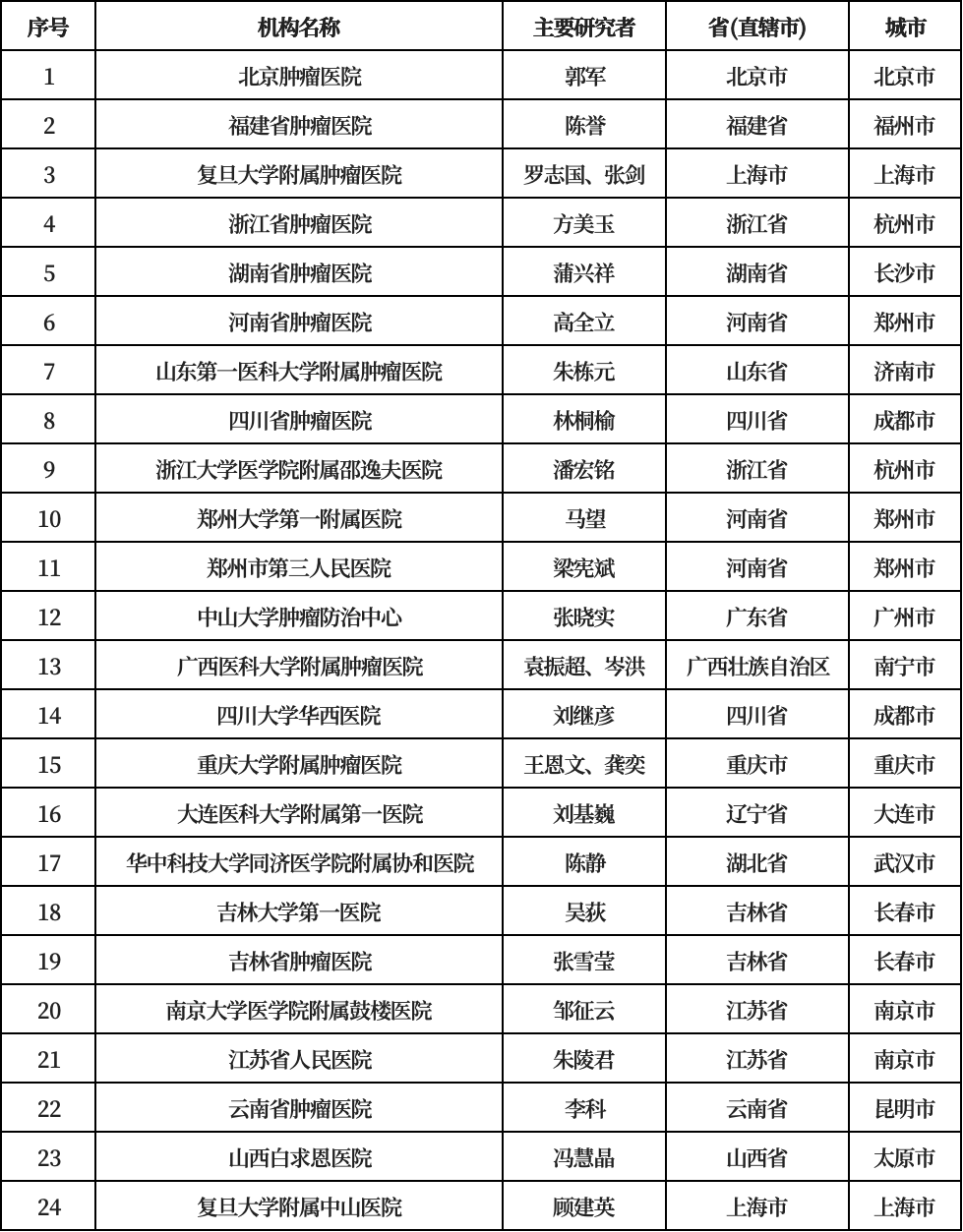
从2025年1月中旬至今,MIZAR-003项目已陆续启动三家临床分中心。日渐浓烈的节日气氛,并未迟缓项目推进速度,松懈项目组成员紧张有序的工作状态。
华中科技大学同济医学院附属协和医院肿瘤中心肉瘤与黑色素瘤科主任陈静教授及相关临床研究团队,君赛生物副总裁林树伟及相关支持人员参加此次启动会。
华中科技大学同济医学院附属协和医院肿瘤中心肉瘤与黑色素瘤科主任陈静教授表示:“TIL疗法代表着恶性黑色素瘤治疗方案的创新趋势,君赛生物GC101 TIL前期临床数据展现出的良好安全性、有效性及临床管理便利性得到大家一致认可。医院内部及外院的许多外科专家都在关注MIZAR-003项目,期待能为项目开展贡献力量。我们也将加速推进患者入组,为更多的恶性黑色素瘤患者带来创新治疗选择和临床获益!”
关于黑色素瘤
黑色素瘤是一种侵袭性皮肤癌,其发病率不断上升,是一个全球性的健康问题。2024年2月16日,全球首个TIL疗法Lifileucel经美国FDA批准上市,针对PD-1抗体治疗失败的晚期黑色素瘤,标志着实体瘤细胞治疗时代的开启。
我国的黑色素瘤病理类型与欧美差异大,预后更差。欧美患者疾病亚型以皮肤型为主(约占90%);而我国患者肢端型为主(约占50%),黏膜型占比约17%,而皮肤型占比仅约10%~20%。2022年中国黑色素瘤新发人数占全球2.7%,但死亡数占全球的9.2%,死亡率更高,治疗需求迫切。
关于GC101
GC101依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增平台开发而成,是君赛生物研发进度最快的TIL疗法管线,也是全球首款无需清淋、无需IL-2注射的天然TIL疗法。
已有临床数据显示,GC101针对多种类型晚期实体肿瘤的客观缓解率(ORR)超35%,已有4例患者肿瘤被完全清除,获得完全缓解(CR)疗效,其中无瘤生存最久时间已超3年。
关于MIZAR-003临床试验
MIZAR-003项目是一项开放标签、随机、对照、多中心关键II期临床试验,旨在评估GC101 TIL细胞疗法在晚期黑色素瘤患者中的有效性与安全性。目前,MIZAR-003临床试验分中心正在迅速启动。
主要入组标准:
1、18-75岁,男女不限;
2、不可切除的晚期、复发或转移性黑色素瘤患者(葡萄膜黑色素瘤除外);
3、经PD-1抗体治疗失败或不耐受;
4、至少2个病灶,身体可支持微创手术取材。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
杨老师:18019732895(同微信)
张老师:18001759113(同微信)