君赛生物GC203完成首例受试者知情同意书签署
2024年5月30日,君赛生物基因修饰TIL疗法GC203的I期临床试验(KUN-LUN-01)完成首例受试者知情同意书(ICF)签署。GC203是全球首款非病毒载体基因修饰TIL疗法,在前期探索性临床研究中,展现出良好的安全性与有效性,受到许多患者或家属的关注。因而,在启动会召开的第二天,即顺利完成首例受试者ICF签署。
该例受试者2021年确诊宫颈癌,历经手术、放化疗和姑息性治疗等多种方案治疗,备受疾病痛苦与折磨,但遗憾疗效欠佳,且已发生双肺转移。经系统调研与慎重考虑,自愿报名参加GC203的临床试验。
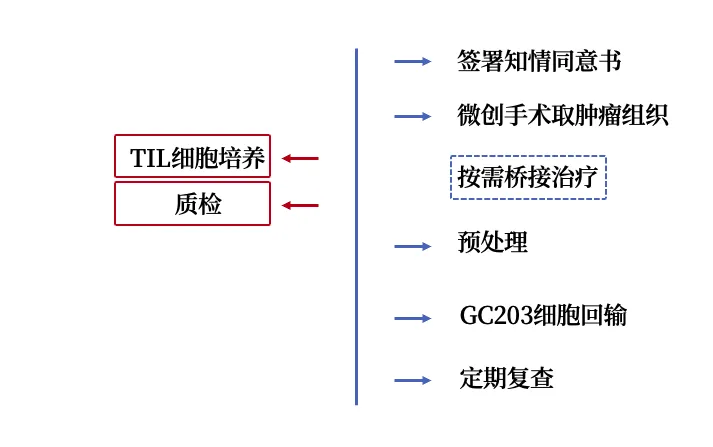
签署知情同意书后,患者将要进行的治疗流程如下:
关于GC203
GC203依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台开发而成,通过非病毒载体介导的基因工程技术,使天然TIL细胞稳定表达膜结合型、可自发聚集的细胞因子IL-7。此前已斩获国家科技部“全国颠覆性技术创新大赛”最高奖项,并入选颠覆性技术储备库。
无需清淋、无需IL-2联用、普通病房内接受GC203回输治疗后,多例恶性程度高、多线治疗失败的妇科肿瘤患者肿瘤明显缩小,且长期缓解。其中,所有入组的宫颈癌患者,肿瘤均不同程度明显缩小;对铂类耐药的卵巢癌患者,可高比例客观缓解。3例患者肿瘤被完全清除,达到CR疗效。同时,接受TIL细胞回输并得到疾病控制的患者,未再行后续放化疗,生活质量得到明显改善。
更多GC203前期临床试验的数据将于美国时间6月3日于美国临床肿瘤学会(ASCO)上公布(详见君赛生物GC203摘要已公布于ASCO网站)。
关于KUNLUN-01 临床试验
GC203 TIL-ST-I(KUNLUN-001)项目是一项I 期、单臂、开放标签的临床试验,旨在评价 GC203 TIL细胞疗法治疗晚期恶性实体瘤患者的安全性、耐受性,以及初步有效性,并探索可能与疗效相关的生物标志物。
主要入组标准:
1、18-75岁,男女不限;
2、确诊的宫颈癌、卵巢癌、子宫内膜癌、乳腺癌、消化系统肿瘤、肺癌等;
3、经标准治疗失败或缺乏有效治疗方法;
4、至少2个病灶,身体可支持微创手术取材;
5、ECOG评分0-1分;
6、有足够的血液学和终末器官功能。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
3、脑转移且导致器质性精神障碍;
4、1年内接受过基因工程改造细胞治疗。
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
张老师:18019732895(同微信)
程老师:18001759113(同微信)
温馨提示:
为了提高研究者的审核效率,建议提前收集整理好如下材料:
1、近期影像报告(最好能动态查看);
2、近期血常规、血生化报告;
3、近期重大传染病报告(乙肝、丙肝、梅毒、艾滋);
4、治疗病史。
关于君赛生物
君赛生物专注于TIL疗法的开发,自主建立国际领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台,据此开发一系列全球领先的TIL创新疗法,其中2款已进入临床试验阶段,正面向社会招募晚期实体肿瘤患者。
全球首款无需清淋、无需IL-2注射的天然TIL疗法GC101,以及全球首创的非病毒载体基因修饰TIL疗法GC203,在9种不同类型晚期实体肿瘤中均展现优异临床疗效(包括多线治疗失败的胰腺癌与高级别脑胶质瘤),其中7例患者肿瘤被完全清除,无瘤生存最久时间已近3年。
君赛生物将坚守“精雕细胞,守望生命”的崇高使命,胸怀“以科技创奇迹,使奇迹变平常”的美好愿景,秉承“专注、拓新、包容、共享”的核心价值观,开发更多高品质的TIL创新疗法,满足广大癌症患者的差异化需求。
更多信息请访问:www.juncell.com
