42天缩小40%,温和的GC203对肿瘤不温柔
近日,君赛生物基因修饰型TIL疗法GC203在I期临床试验(KUNLUN-001)研究分中心重庆大学附属肿瘤医院完成首例受试者细胞回输后的首次肿瘤评估,患者肿瘤整体缩小约40%,达到部分缓解(PR)。
GC203是全球首款非病毒载体基因修饰TIL疗法,于2024年4月28日经NMPA批准进入临床试验,是目前国内唯一一个正式开展注册临床试验的基因修饰TIL疗法。
该产品依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台开发而成,采用非病毒载体,在无高浓度IL-2、无滋养细胞的条件即可培养出足量高活性的TIL细胞,且对IL-2无依赖性,解决了常规TIL疗法依赖大剂量化疗清淋预处理,大剂量IL-2注射的临床痛点。
此前,GC203的安全性已得到亲历临床的受试者与研究者的实证,首次肿瘤评估达到PR进一步确证了GC203颇具前景的临床疗效,有望为更多患者带来新的治疗选择!
H女士从未想过有一天自己会登上肿瘤浸润淋巴细胞(TIL)这辆“细胞治疗复兴号”。
2023年初,H女士察觉腹股沟和腰部偶发疼痛,当时并未予以重视。直到3月份,疼痛不断加剧,在家人提醒下,H女士入院检查才发现自己腹膜后、腹股沟等多处的淋巴结肿大,已存在肿瘤转移可能。H女士于2023年3月首次进行了手术探查,术后病理结果证时了该疾病并非简单的疼痛,而是卵巢高级别浆液性癌(high-grade serous ovarian cancer,HGSOC),并且已经到了IVB期。
卵巢癌是我国女性生殖系统第四大确诊癌症,呈逐年上升的趋势,严重威胁女性健康。上皮性卵巢癌中约70%为HGSOC,是一种具有侵袭性特征的常见亚型,高达70%的HGSOC患者在确诊时已处于盆腔外腹膜转移状态(Ⅲ/Ⅳ期)。全面分期手术和辅助化疗是HGSOC的标准疗法,然而约70%的患者会在术后2年内复发,进而产生继发性耐药。
H女士一年多来认真接受传统治疗,先后进行了新辅助化疗、妇科晚期肿瘤减瘤手术,一线化疗联合抗血管生成药物以及免疫治疗,后期使用PARP抑制剂维持。漫漫抗癌路使H女士身心俱疲,健康每况愈下,今年8月份,肿瘤竟再次复发。
这次H女士有了一个新的选择--TIL细胞疗法!然而,常规TIL疗法繁琐的治疗过程,清淋化疗、IL-2注射带来的不良反应,长时间的住院重症监护让H女士及家人迟迟难以下定决心。
在仔细了解GC203无需清淋级预处理、无需IL-2注射、普通病房即可治疗的临床方案,及前期临床试验中GC203展现出的良好安全性和疗效后,H女士放下顾虑,参与了君赛生物GC203的这项临床试验。
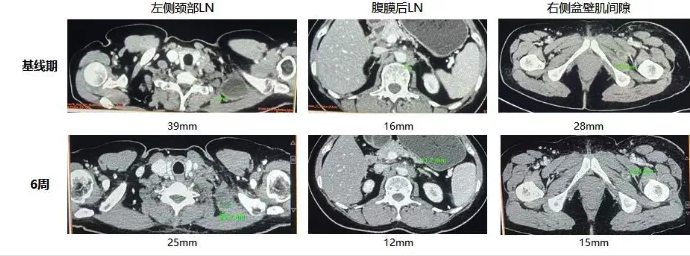
整个治疗过程仅出现持续几小时的发热和一过性的血象降低,出院时H女士身体状态一切良好。在之后的出院随访中也未见任何异常,接受治疗后的28天,H女士感受到左侧颈部的淋巴结已较前缩小。
42天后的第一次肿瘤评估,H女士的整体肿瘤竟缩小了37.3%,CA125也较之前大幅度降低。
重庆大学附属肿瘤医院I期病房的主要研究者龚奕主任在此前就曾表示,君赛生物新一代基因修饰型TIL GC203仅需低强度预处理和无需IL-2注射的方案较既往管理过的传统TIL项目,不仅在安全性上有巨大的提升,不良反应也一直在可预知可控范围内。
这次H女士回院肿瘤评估后,龚主任高兴地表示:“在保证安全的前提下,GC203 TIL的产品疗效也同样充满了惊喜,首个受试者首次肿瘤评估就已经达到了PR,肿瘤缩小了约40%,我更加期待此疗法能够早日惠及更多的受试者。”
关于GC203
GC203依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台开发而成,通过非病毒载体介导的基因工程技术,使天然TIL细胞稳定表达膜结合型、可自发聚集的细胞因子IL-7。此前已斩获国家科技部“全国颠覆性技术创新大赛”最高奖项,并入选颠覆性技术储备库。
无需IL-2注射、仅需低强度化疗预处理、普通病房内接受GC203回输治疗后,多例恶性程度高、多线治疗失败的妇科肿瘤患者肿瘤明显缩小,且长期缓解。其中,所有入组的宫颈癌患者,肿瘤均不同程度明显缩小;对铂类耐药的卵巢癌患者,可高比例客观缓解。3例患者肿瘤被完全清除,达到CR疗效。同时,接受TIL细胞回输并得到疾病控制的患者,未再行后续放化疗,生活质量得到明显改善。
GC203前期临床试验的数据已于2024年美国临床肿瘤学会(ASCO)上公布。
关于KUNLUN-001临床试验
GC203 TIL-ST-I(KUNLUN-001)项目是一项I期、单臂、开放标签的临床试验,旨在评价GC203 TIL细胞疗法治疗晚期恶性实体瘤患者的安全性、耐受性,以及初步有效性,并探索可能与疗效相关的生物标志物。
本临床试验项目已在复旦大学附属肿瘤医院、上海市第十人民医院、天津市肿瘤医院、浙江大学医学院附属第二医院、华中科技大学同济医学院附属协和医院、重庆大学附属肿瘤医院正式启动,现正在进行受试者招募及筛选,招募主要标准如下。
主要入组标准:
1、18-75岁,男女不限;
2、确诊的宫颈癌、卵巢癌、子宫内膜癌、乳腺癌、消化系统肿瘤、肺癌等;
3、经标准治疗失败或缺乏有效治疗方法;
4、至少2个病灶,身体可支持微创手术取材;
5、ECOG评分0-1分;
6、有足够的血液学和终末器官功能。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
3、脑转移且导致器质性精神障碍;
4、1年内接受过基因工程改造细胞治疗。
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
杨老师:18019732895(同微信)
张老师:18001759113(同微信)
温馨提示:
为了提高研究者的审核效率,建议提前收集整理好如下材料:
1、近期影像报告(最好能动态查看);
2、近期血常规、血生化报告;
3、近期重大传染病报告(乙肝、丙肝、梅毒、艾滋);
4、治疗病史。
