君赛生物GC101关键II期临床试验启动会顺利召开
2024年12月26日,君赛生物申办的“一项自体天然肿瘤浸润淋巴细胞注射液(GC101 TIL)治疗晚期黑色素瘤患者的多中心、随机对照、开放标签、II期临床试验(MIZAR-003)”,在组长单位北京大学肿瘤医院顺利召开启动会。北京大学肿瘤医院副院长、黑色瘤与肉瘤内科主任、泌尿肿瘤内科主任郭军教授及临床研究团队,君赛生物副总裁林树伟及临床医学团队参加此次项目启动会。
自GC101 TIL疗法关键性II期临床试验获国家药监局药品审评中心(CDE)批准,经过多方努力,以最快的速度完成启动前的各项准备工作。整个过程充分反映项目团队以患者为中心、急患者之所急的理念;体现主要研究者郭军教授和医院相关部门对君赛生物GC101产品安全性和有效性的认可;体现第三方合作伙伴的高效协同与配合;也体现君赛生物临床团队的强大执行力。各方的有力支持与流畅配合,必将助力MIZAR-003项目的快速推进。
黑色素瘤是一种侵袭性皮肤癌,其发病率不断上升,是一个全球性的健康问题。2024年2月16日,全球首个TIL疗法Lifileucel经FDA批准上市,针对PD-1抗体治疗失败的晚期黑色素瘤,标志着实体瘤细胞治疗时代的开启。
我国的黑色素瘤病理类型与欧美差异大,预后更差。欧美患者疾病亚型以皮肤型为主(约占90%);而我国患者肢端型为主(约占50%),黏膜型占比约17%,而皮肤型占比仅约10%~20%。2022年中国黑色素瘤新发人数占全球2.7%,但死亡数占全球的9.2%,死亡率更高,治疗需求迫切。
GC101依托君赛生物自主开发的DeepTIL®细胞扩增平台研发而成,无需滋养细胞、无需高浓度IL-2即可培养出足够数量的高活性TIL细胞,且对IL-2无依赖性。
在临床应用中,有别于因需要高强度的清淋化疗和大剂量IL-2重复注射,而引发众多不良反应,导致被FDA给予了黑框警告的Lifileucel,GC101无需清淋和任何剂量的IL-2注射就能展现出卓越的疗效。
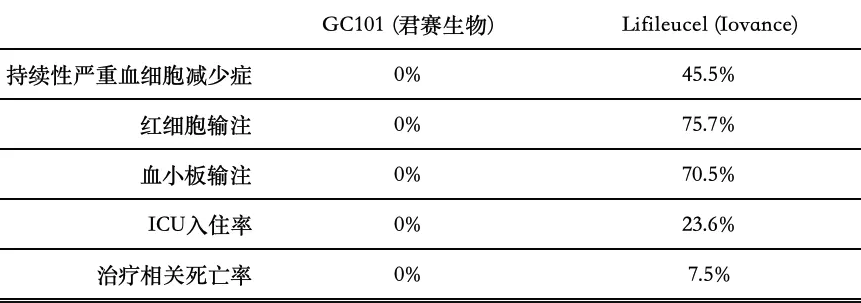
同时,Lifileucel的客观响应率(ORR)达31.5%,中位无进展生存期(mPFS)为4.1个月。尽管GC101的受试者主要是更难治疗的肢端和黏膜型黑色素瘤患者,但其ORR与Lifileucel相似,且mPFS延长了一个多月。在安全性方面,相比Lifileucel(表1),GC101的受试者在普通病房接受治疗,没有出现治疗相关的死亡和ICU入住案例,也没有患者需要接受血细胞输注,住院时间缩短了约80%。
表1 GC101与Lifileucel安全性相关数据
此次,GC101获准在亚洲最大、国际权威的恶性黑色素瘤治疗中心——北京大学肿瘤医院开展关键II期临床试验,并由中国临床肿瘤学会(CSCO)副理事长兼秘书长、CSCO黑色素瘤专家委员会主任委员、国际黑色素瘤协会(MWS)副主席、国际黑色素瘤研究联盟(Society for Melanoma Research)亚太地区主席、国际黑色素瘤基金会(MIF)海外咨询顾问、北京大学肿瘤医院副院长、黑色瘤与肉瘤内科主任、泌尿肿瘤内科主任郭军教授担任此项临床研究的PI,必将加速GC101关键II期临床试验进程。
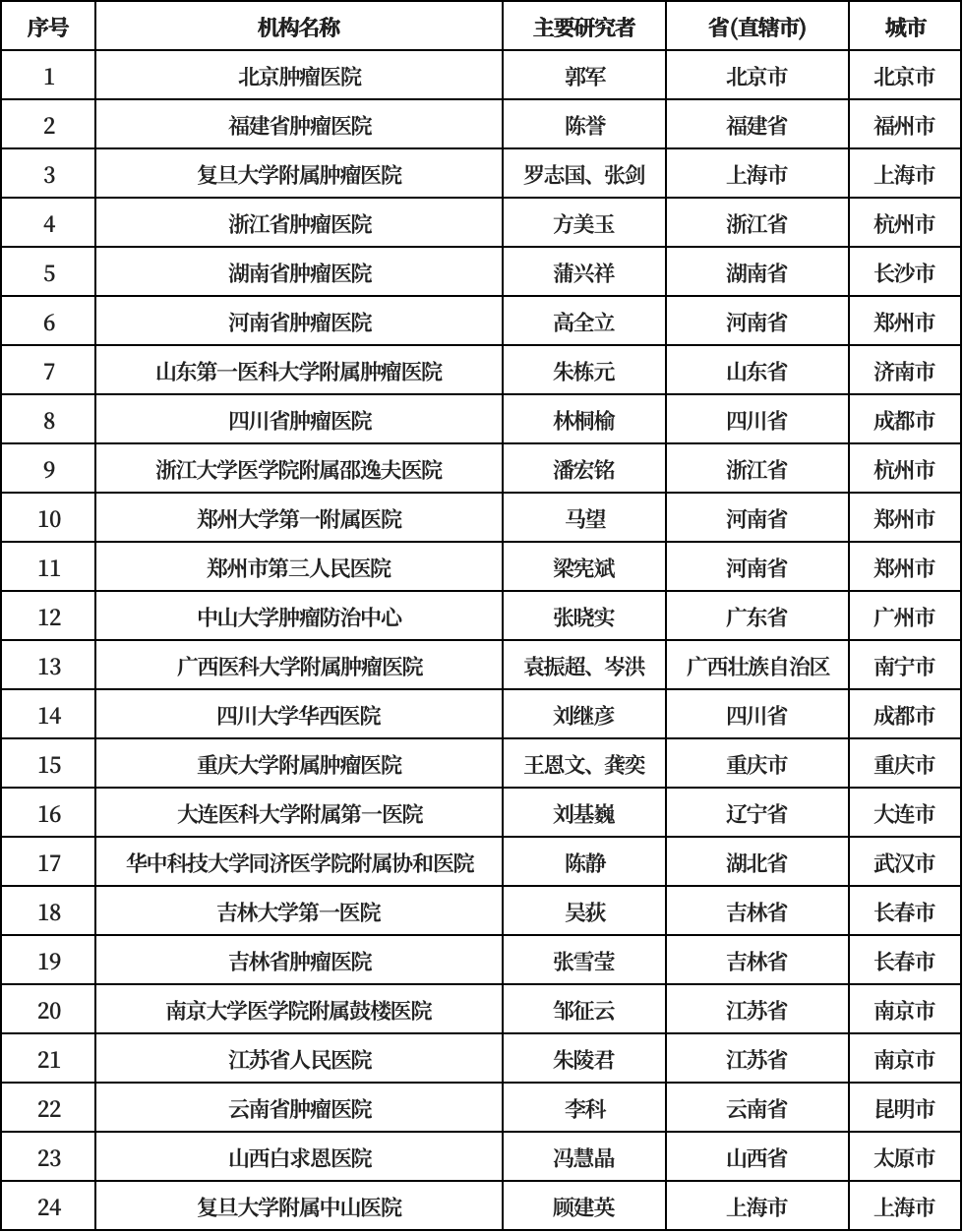
后续,MIZAR-003项目将快速在全国20个省(直辖市、自治区)的23个分中心启动,汇聚国内黑色素瘤领域顶尖机构与专家协力推动项目开展。
北京大学肿瘤医院副院长、黑色瘤与肉瘤内科主任、泌尿肿瘤内科主任郭军教授表示:“肿瘤浸润淋巴细胞(TIL)疗法在黑色素瘤治疗中取得突破,为未来黑色素瘤的综合治疗奠定了基础。君赛生物GC101 TIL,在前期临床试验中已展现出有别于传统TIL疗法的良好安全性和疗效,提高临床管理便利性,进一步提高患者临床可及性,我们期待GC101的关键II期临床试验数据能进一步展现积极疗效,为中国的晚期黑色素瘤患者带来新的希望。”
关于GC101
GC101依托君赛生物自主开发、全球领先的DeepTIL®细胞富集扩增平台开发而成,是君赛生物研发进度最快的TIL疗法管线,也是全球首款无需清淋、无需IL-2注射的天然TIL疗法。
已有临床数据显示,GC101针对多种类型晚期实体肿瘤的客观缓解率(ORR)超35%,已有4例患者肿瘤被完全清除,获得完全缓解(CR)疗效,其中无瘤生存最久时间已超3年。
关于MIZAR-003临床试验
MIZAR-003项目是一项开放标签、随机、对照、多中心关键II期临床试验,旨在评估GC101 TIL细胞疗法在晚期黑色素瘤患者中的有效性与安全性。
主要入组标准:
1、18-75岁,男女不限;
2、不可切除的晚期、复发或转移性黑色素瘤患者(葡萄膜黑色素瘤除外);
3、经PD-1抗体治疗失败或不耐受;
4、至少2个病灶,身体可支持微创手术取材。
主要排除标准:
1、有严重基础性疾病;
2、有重大传染性疾病;
联系方式:
临床邮箱:clinicaltrials@juncell.com
联系电话:021-69990503
杨老师:18019732895(同微信)
程老师:18001759113(同微信)
关于君赛生物
君赛生物专注于TIL疗法的开发,自主建立国际领先的DeepTIL®细胞富集扩增与NovaGMP®基因修饰技术平台,据此开发一系列全球领先的TIL创新疗法,其中2款已进入临床试验阶段,正面向社会招募晚期实体肿瘤患者。
全球首款无需清淋、无需IL-2注射的天然TIL疗法GC101,以及全球首创的非病毒载体基因修饰TIL疗法GC203,在10种不同类型晚期实体肿瘤中均展现优异临床疗效(包括多线治疗失败的胰腺癌与高级别脑胶质瘤),其中7例患者肿瘤被完全清除,无瘤生存最久时间已超3年。
君赛生物将坚守“精雕细胞,守望生命”的崇高使命,胸怀“以科技创奇迹,使奇迹变平常”的美好愿景,秉承“专注、拓新、包容、共享”的核心价值观,开发更多高品质的TIL创新疗法,满足广大癌症患者的差异化需求。
